Evolution neu: Was den Krebs bösartiger macht
(Wien, 23.09.2022) Wir gratulieren! Soeben wurde eine Publikation im Top-Journal Nature Genetics veröffentlicht, an der auch Dr. Sabine Taschner-Mandl und Dr. Marie Bernkopf von der St. Anna Kinderkrebsforschung mitwirken. Die Autor:innen dieser herausragenden Arbeit haben gezeigt, dass zufällige Vererbungsmuster von Krebsgenen außerhalb der Chromosomen, dem Gerüst für die Erbinformation im Zellkern, zu schlechten Behandlungsergebnissen beitragen.
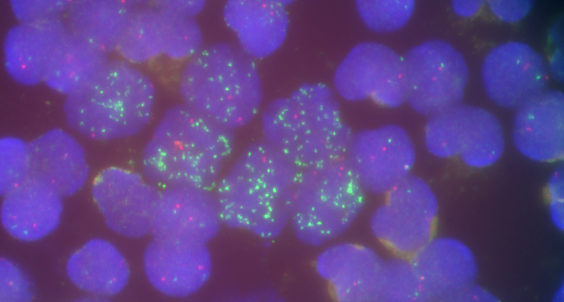
Bei vielen Tumorarten wie z.B. dem kindlichen Neuroblastom und dem Glioblastom, werden Krebsgene, sogenannte Onkogene, nicht nur in den Chromosomen des Zellkerns selbst aktiviert bzw. vermehrt, sondern als extrachromosomale DNA (ecDNA) auch außerhalb. Das führt zu aggressivem Tumorwachstum, Arzneimittelresistenz und einer kürzere Überlebensdauer. Die zugrundeliegenden Mechanismen dieser nicht-chromosomalen Weitergabe von Onkogenen bei der Tumorzellteilung waren bislang nur wenig bekannt.
DNA außerhalb des Chromosoms macht Tumor anpassungsfähiger
In der vorliegenden Studie wurde mathematisch modelliert und experimentell untersucht, wie sich ecDNA auf die Tochterzellen verteilt, was das für einen Einfluss auf die Aggressivität der Tumorzellen hat und welche Auswirkungen die Krebstherapie auf die ecDNA von Patient:innen hat.
Bei der Zellteilung ist die Aufteilung der Chromosomen im Normalfall genauestens geregelt, sodass jede Tochterzelle eine exakte Gen-Kopie der Mutterzelle erhält. Bei der extrachromosomalen Vermehrung werden die DNA-Abschnitte nach dem Zufallsprinzip auf die Tochterzellen verteilt. So kann es sein, dass eine Zelle nur eine, eine andere jedoch 100 Kopien eines Onkogens erhält. Das hat großen Einfluss auf die Anpassungsfähigkeit eines Tumors. Darüber hinaus begünstigen ecDNAs das Überleben und Wachstum der Tumorzellen. Unter Therapie wiederum kann ecDNA zurück in die Chromosomen eingebaut und damit wieder stabilisiert werden.
„Unser Beitrag zu dieser Studie war die Analyse der extrachromosomalen Vermehrung des Krebsgens MYCN vor und nach der Behandlung. Das haben wir in Tumorproben aus unserer Neuroblastom-Forschungs- und Diagnostik-Datenbank untersucht. Bei einem Patienten konnten wir zeigen, dass die Krebstherapie den evolutionären Druck auf den vervielfältigten DNA-Abschnitt von MYCN so stark erhöhte, dass er wieder zurück ins Chromosom integriert wurde. Unsere Daten dienten als Grundlage für die mathematischen Modelle dieser Publikation“, erklärt Dr. Sabine Taschner-Mandl, Leiterin der Forschungsgruppe Tumor Biologie der St. Anna Kinderkrebsforschung, die in diesem Projekt mit einem der Studienleiter, Dr. Anton Hensson von der Charité Berlin, zusammenarbeitete.
Zur Publikation >> „Lange et al., Nature Genetics 2022“ https://www.nature.com/articles/s41588-022-01177-x
