CAR-T-Zelltherapie
Dieser Artikel behandelt die folgenden Themen:
Wie funktioniert die CAR-T-Zelltherapie?
Wie werden T-Zellen entnommen?
Wie werden CAR-T-Zellen hergestellt?
Warum werden ausgerechnet T-Zellen verwendet?
Die CAR-T-Zelltherapie ist eine moderne Form der Immuntherapie, bei der die körpereigenen Abwehrzellen gezielt gegen Krebszellen aktiviert werden. Durch eine genetische Veränderung erhalten T-Zellen spezielle Rezeptoren (sogenannte chimäre Antigen Rezeptoren, kurz CAR), mit denen die T-Zellen dann bestimmte Tumorzellen erkennen und gezielt bekämpfen können. Diese Therapie hat das Potenzial, besonders aggressive Krebsformen zu behandeln, die auf andere Therapien nicht ansprechen.
Ablauf der Therapie
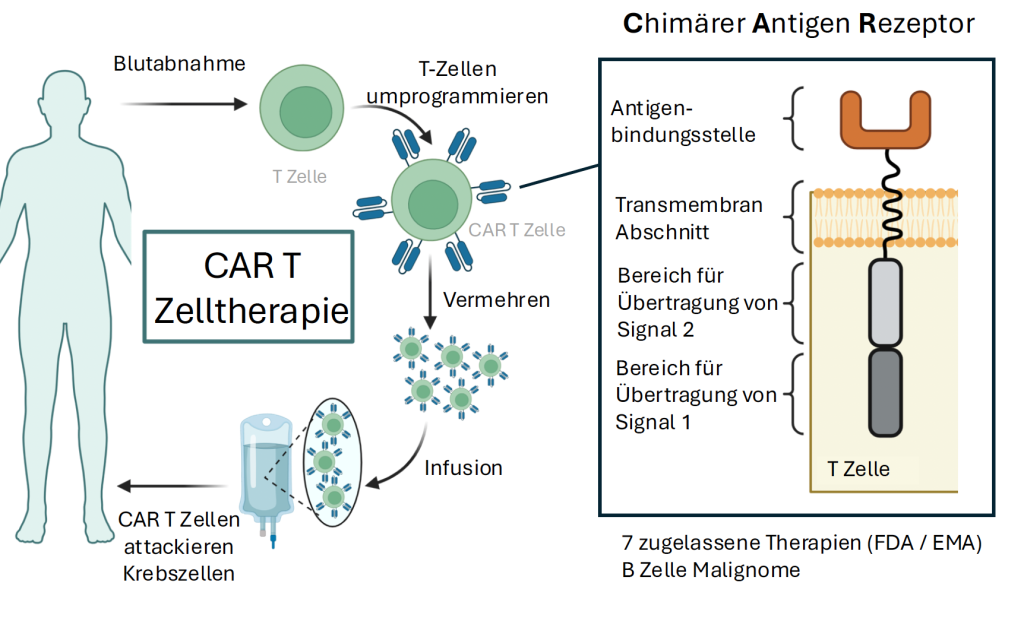
Wie funktioniert die CAR-T-Zelltherapie?
Der Ablauf beginnt mit der Entnahme von T-Zellen aus dem Blut der Patient*innen. Dies erfolgt über eine spezielle Art der Blutwäsche, bei der die weißen Blutkörperchen isoliert werden. Im Labor werden die T-Zellen dann gentechnisch so verändert, dass sie gezielt ein spezifisches Protein auf der Oberfläche von Krebszellen erkennen können. Ein Beispiel dafür ist das Protein CD19, das bei bestimmten Leukämien auftritt.
Die modifizierten T-Zellen werden dann außerhalb des Körpers sehr stark vermehrt, um genügend Zellen für die Therapie zu erzeugen. Dies passiert in speziellen Geräten und in sogenannten Reinräumen, damit das Zellprodukt nicht mit Mikroben kontaminiert wird. Erst nachdem die Reinheit und die Qualität der Zellen überprüft wurde, dürfen die Zellen verabreicht werden.
Bevor die Patient*innen die CAR-T-Zellen erhalten können, erhalten die Patient*innen eine niedrig dosierte Chemotherapie, um Platz für die neuen Immunzellen zu schaffen. Schließlich werden die CAR-T-Zellen über eine Infusion zurückgegeben. Im Körper vermehren sie sich weiter, suchen die Krebszellen auf und zerstören sie gezielt. Die Patient*innen bleiben in den ersten Tagen oder Wochen noch im Krankenhaus, um sicherzustellen, dass keine schweren Nebenwirkungen auftreten.
Biologische Hintergründe
Wie werden T-Zellen entnommen?
Die Basis der CAR-T-Zelltherapie sind die eigenen T-Zellen der Patient*innen – das vermeidet Abstoßungsreaktionen und andere Komplikationen, wie zum Beispiel, dass die fremden T-Zellen den eigenen Körper als fremd wahrnehmen und angreifen. Um die T-Zellen zu gewinnen, wird eine sogenannte Leukapherese durchgeführt – ein Verfahren, bei dem die weißen Blutkörperchen, einschließlich der T-Zellen, aus dem Blut gefiltert werden. Dabei wird das Blut durch eine spezielle Maschine geleitet, die die benötigten Zellen isoliert, während der Rest des Blutes wieder in den Körper zurückfließt.
Die entnommenen weißen Blutzellen werden im Labor weiterverarbeitet.
Wie werden CAR-T-Zellen hergestellt?
Im Labor müssen die Wissenschafter*innen ein künstliches Gen in die T-Zelle einbauen, das für die Erzeugung des chimären Antigenrezeptors (CAR) zuständig ist. Mithilfe dieses künstlichen Rezeptors können die T-Zellen an die Tumorzellen andocken indem sie spezifische Marker auf ihrer Oberfläche erkennen.
Die Einschleusung des künstlichen Gens in die T-Zellen erfolgt unter Verwendung viraler Vektoren als Transportmittel.
Nach der erfolgreichen genetischen Modifikation werden die T-Zellen im Reinraumlabor in nährstoffreichen Medien vermehrt. Dort beginnen sie, das CAR-Protein an ihrer Oberfläche zu bilden. Die Forscher*innen überwachen die Kulturen genau, um sicherzustellen, dass die CAR-T-Zellen ihre Funktion beibehalten und keine unerwünschten mikrobiologischen Keime in das CAR-T-Zellprodukt gelangen.
Warum werden ausgerechnet T-Zellen verwendet?
T-Zellen spielen eine zentrale Rolle in der Immunabwehr. Sie eignen sich besonders für die CAR-T-Zelltherapie aus folgenden Gründen:
- Gezielte Zytotoxizität: T-Zellen, insbesondere die zytotoxischen (CD8+ T-Zellen), sind darauf spezialisiert, infizierte Zellen zu zerstören. Dazu benutzen sie normalerweise ihren sogenannten „T-Zellrezeptor“. Der CAR funktioniert ähnlich wie der T-Zellrezeptor und kann damit die gleichen Funktionen in den T-Zellen auslösen. Das macht sie ideal für die Bekämpfung von Tumorzellen.
- Langfristige Immunantwort: T-Zellen haben die Fähigkeit, nach der Aktivierung langlebige Gedächtniszellen zu bilden. Diese Gedächtniszellen können bei erneuter Tumoraktivität wieder aktiviert werden, was zu einer nachhaltigen Therapie führt.
- Flexibilität und Skalierbarkeit: Sie lassen sich im Labor relativ leicht vermehren und ihre Funktion bleibt auch nach genetischer Modifikation erhalten.
Neben den T-Zellen gibt es noch die sogenannten natürlichen Killerzellen (NK-Zellen), welche ebenfalls andere Zellen sehr effizient abtöten können. NK-Zellen haben dabei den Vorteil, dass sie Tumorzellen unabhängig von spezifischen Antigenen erkennen können. Allerdings ist ihre Lebensdauer im Körper begrenzt, sie bilden keine langlebigen Gedächtniszellen, sie lassen sich nicht so leicht vermehren und Tumorzellen können sich leichter vor dem Angriff von NK-Zellen schützen.
Anwendungsgebiete und Wirksamkeit
Die CAR-T-Zelltherapie wird hauptsächlich bei Blut- und Lymphdrüsenkrebsarten wie der akuten lymphatischen Leukämie (ALL) und Non-Hodgkin-Lymphomen (NHL) eingesetzt. Diese Krebsarten entstehen durch Entartung von B-Zellen und eignen sich daher besonders gut für diese innovative Therapie, da sich diese entarteten B-Zellen ohne lebensbedrohliche Nebenwirkungen angreifen lassen. Entartete B-Zellen tragen an ihrer Oberfläche große Mengen vom Antigen „CD19“. Dieses Antigen findet sich zwar auch auf der Oberfläche von gesunden B-Zellen, welche dadurch ebenfalls abgetötet werden. Allerdings kann man das in Kauf nehmen, da man auch ohne B-Zellen gut leben kann. Für andere Krebsarten müssen andere Antigene angegriffen werden. Diese Antigene finden sich meist auch auf gesunden Zellen, welche nicht angegriffen werden dürfen, da dies sonst zu schweren und sogar tödlichen Schäden führen würde.
Ein weiterer Vorteil ist, dass Blut- und Lymphkrebszellen im Blut oder in den lymphatischen Organen zirkulieren, wodurch sie für die CAR-T-Zellen gut erreichbar sind. Krebszellen, welche in festem Gewebe wachsen („solide Tumore“) stellen hingegen eine größere Herausforderung dar. Oft können sie nur über Antigene angegriffen werden, welche auch den Angriff von lebensnotwendigem gesundem Gewebe zur Folge haben. Zusätzlich erschwert das dichte Tumorgewebe den CAR-T-Zellen den Zugang zu den Krebszellen, und das Krebsgewebe enthält oft Stoffe, welche die Funktion der CAR-T-Zellen unterdrücken.
Leider ist ein häufiges Problem auch die hohe Anpassungsfähigkeit von Krebszellen. Krebszellen können sich verändern und ihre Oberflächenmarker verlieren, sodass sie für die CAR-T-Zellen unsichtbar werden. Diese sogenannte „Antigenflucht“ ist eine der Hauptursachen dafür, dass sich Krebszellen nach der Therapie oft wieder vermehren können.
Trotz dieser Herausforderungen bietet die CAR-T-Zelltherapie eine vielversprechende Möglichkeit, besonders bei Patient*innen, bei denen andere Behandlungsansätze versagt haben. Die Forschung arbeitet intensiv daran, die Therapie auch für solide Tumore und andere Krebsarten nutzbar zu machen, indem man die Wirksamkeit erhöht und gleichzeitig die Nebenwirkungen minimiert.
