Automatisierte Tests von Kinderkrebstherapien

(Wien, 29.6.2023) Mit Hilfe eines neuartigen Hochdurchsatzverfahrens können zahlreiche Medikamente gleichzeitig auf ihre Wirksamkeit getestet werden. Forschende sind damit in der Lage, schnell und effizient zu beurteilen, welche Substanzen gegen welchen Tumor wirken. Ein Team um Dr. Martin Distel und Dr. Sabine Taschner-Mandl von der St. Anna Kinderkrebsforschung liefert nun erstmals eine Anleitung, wie man im Zebrafischmodell mit diesem Verfahren die Empfindlichkeit von kindlichen Tumoren auf verschiedene Medikamente testen kann. Eine entsprechende Studie wurde im Fachjournal npj Precision Oncology veröffentlicht.
Die aktuelle wissenschaftliche Publikation kann als Anleitung zur Behandlung unterschiedlichster Tumorarten gelesen werden. „Wir haben mit renommierten Laboren auf der ganzen Welt zusammengearbeitet und Informationen gesammelt, um wirklich einen Standard-Workflow herauszugeben“, sagt Martin Distel, Ko-Corresponding Author der Studie. Diese Standardisierung gab es bisher nicht. Eine Kooperation mit slowenischen Chemiker:innen führte zur Testung einer neuen Substanz in einem Zebrafischmodell für Sarkome. „Unsere Tests zeigen, dass dieser neue Wirkstoff, ein Inhibitor bestimmter Heat-Shock-Proteine, sogar etwas besser wirkt als seine Vorgänger. Aufgrund dieser Erkenntnis wird nun weiter an dem Wirkstoff gefeilt, ein Folgeprojekt ist bereits geplant“, berichtet Dr. Sarah Grissenberger, Ko-Erstautorin der Studie und Postdoktorandin in Distels Team.
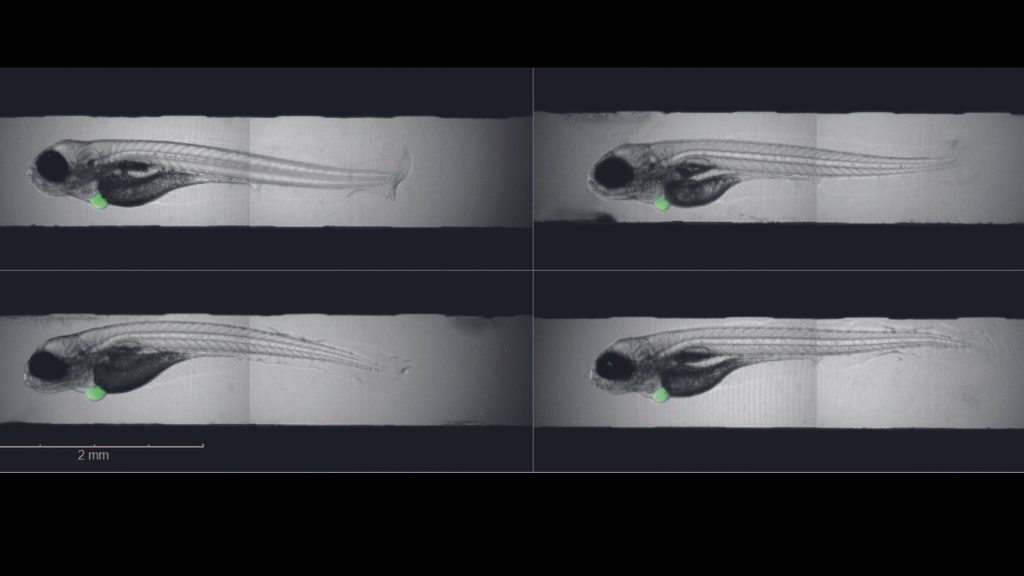
Die Basis für die Arbeit: Transplantationen von menschlichen Tumorzellen in Zebrafischlarven,um Krebsmedikamente zu testen. Die Tumorentwicklung dauert in diesem Fall nur wenige Tage und kann unmittelbar mitverfolgt werden, da die Fischlarven durchsichtig sind. Für ein Gelingen der Forschungen ist Präzisionsarbeit nötig. „Ob der Tumor anwächst, hängt auch davon ab, an welcher Stelle in der Larve wir die Krebszellen einsetzen“, erklärt Dr. Caterina Sturtzel, Ko-Erstautorin der Studie und wissenschaftliche Mitarbeiterin in Martin Distels Zebrafish Platform Austria for preclinical drug screening (ZANDR). Was genau zu beachten ist und wie man das Wachstum maschinell auswertet, hat eine Kooperation der Teams von Martin Distel und Sabine Taschner-Mandl an der St. Anna Kinderkrebsforschung jetzt detailliert beschrieben.
Aussagekräftige Analyse auf Knopfdruck
Neben Leukämien, bestimmten Weichteil-, Knochen- sowie Hirntumoren konzentrierte sich das Team auch auf kindliche Nerventumore, sogenannte Neuroblastome. „Anders als etwa Ewing Sarkome wachsen Neuroblastome nicht immer gleich gut. Wir müssen also jeden einzelnen Tumor an Tag 1 und Tag 3 vergleichen, um das Wachstum zu beurteilen. Dafür haben wir einen Analyseworkflow programmiert, der den Tumor detektiert und diesen Vergleich zwischen Tag 1 und Tag 3 automatisiert durchführt“, erklärt Grissenberger. Umgesetzt wird dieser Vorgang weltweit erstmals von einem High Content Imager namens Operetta CLS.
Taschner-Mandl, Ko-Corresponding Author und Leiterin der Tumor Biology Gruppe an der St. Anna Kinderkrebsforschung, kommentiert: „Wir haben gesehen, dass verschiedene Arten von Neuroblastomen unterschiedlich auf die getesteten Wirkstoffe Ceritinib und Temozolomid reagieren. Das ist enorm wichtig, denn für viele genetische Typen des Neuroblastoms gibt es keine anderen Tiermodelle, in denen klinisch relevante Wirkstoffkombinationen so schnell getestet werden können.“ Für die bestmögliche Aussagekraft müssen die Tumorzellen genau dorthin transplantiert werden, wo sie im Krankheitsfall wachsen.Sarah Grissenberger setzte sich damit auseinander, wie man die Zellen am besten anfärbt, damit der Farbstoff auch wirklich nur die Tumorzellen anfärbt und diese vom High Content Imager erkannt werden. „Zuerst hatten wir einen Farbstoff, den die Zellen verloren haben und der dann auch von anderen Zellen aufgenommen wurde. Das kann in die Irre führen, weil wir dachten: da sind jetzt überall Metastasen. Mit dem jetzigen Farbstoff passiert das aber nicht mehr und wir bekommen aussagekräftige Ergebnisse.“
Die Arbeit des Teams führte zu einem schnellen und effizienten Analyseworkflow mit neuartigen Anwendungsmöglichkeiten. Das große Ziel bleibt, erkrankten Kindern neue Therapien anbieten zu können.
– – –
Publikation
Refined high-content imaging-based phenotypic drug screening in zebrafish xenografts
C. Sturtzel#, S. Grissenberger#, P. Bozatzi, E. Scheuringer, A. Wenninger-Weinzierl, Z. Zajec, J. Dernovšek, S. Pascoal, V. Gehl, A. Kutsch, A. Granig, F. Rifatbegovic, M. Carre, A. Lang, I. Valtingojer, J. Moll, D. Lötsch, F. Erhart, G. Widhalm, D. Surdez, O. Delattre, N. André, J. Stampfl, T. Tomašič, S. Taschner-Mandl* & M. Distel*
#contributed equally
*Corresponding Authors
npj Precision Oncology 2023; May 18; 7:44; DOI: 10.1038/s41698-023-00386-9
https://doi.org/10.1038/s41698-023-00386-9
Förderung
Diese Arbeit wurde unterstützt von der Österreichischen Forschungsförderungsgesellschaft (FFG), der Alex’s Lemonade Stand Foundation, dem Wiener Wissenschafts-, Forschungs- und Technologiefonds (WWTF), der Slowenischen Forschungsagentur, dem Bundesministerium für Bildung, Wissenschaft und Forschung, einem DOC-Stipendium der Österreichischen Akademie der Wissenschaften und Spenden an die St. Anna Kinderkrebsforschung. Dieses Projekt erhielt auch Unterstützung von der Europäischen
Finanzierung H2020-lMI2-JTl-201 5-07. Sanofi hat einen Teil der Medikamententests an Ewing Sarkom Xenografts gesponsert. Das Comprehensive Cancer Center von MedUni Wien und AKH Wien hat die Glioblastomexperimente mitunterstützt.
Über das Medikamenten-Screening in Zebrafischlarven
Zebrafischlarven helfen bei der Suche nach Medikamenten gegen kindliche Krebserkrankungen. Denn die Tumorentwicklung in Fischlarven dauert nur 24 Stunden und kann im durchsichtigen Organismus live verfolgt werden. Forscher:innen der St. Anna Kinderkrebsforschung haben nun einen Arbeitsprozess entwickelt, der in nur einer Woche die halbautomatisierte Testung von bis zu zwölf (Kombinations-)therapien gegen Tumorzellen erlaubt. Die Forscher:innen bringen Tumorzellen von Patient:innen oder aus Zelllinien in Fischlarven ein. Nach 24 Stunden entwickelt sich ein Tumor, der dann sofort behandelt wird. Nach weiteren zwei Tagen sieht man bereits die Wirkung. Somit lassen sich mögliche neue Therapien zu einem sehr frühen Zeitpunkt stark eingrenzen, wodurch viel Zeit gewonnen wird. Dass es überhaupt möglich ist, viele Medikamente in so kurzer Zeit in einem lebenden Organismus zu testen, ist ein riesiger Fortschritt. Weltweit gibt es nur wenige Labore, die solche Screenings durchführen können.
Über das Neuroblastom
Neuroblastome sind die häufigsten soliden Tumore außerhalb des Gehirns bei Kindern. Hochrisiko-Neuroblastome sind jene Tumore, die eine MYCN-Amplifikation aufweisen oder metastasierte Tumore ab einem Alter von achtzehn Monaten. Die Prognose für diese Gruppe ist leider immer noch unbefriedigend, nur etwa die Hälfte der Kinder mit Hochrisiko-Neuroblastomen überlebt die Erkrankung langfristig. Zur derzeitigen Standardbehandlung zählen Chemotherapie, Operation, autologe Stammzelltransplantation, sowie Isotretionin in Kombination mit Immuntherapie. Neue Ansätze werden dringend benötigt.
Über Martin Distel
Dr. Martin Distel (PhD) absolvierte ein Studium der Molekularen Biotechnologie an der Technischen Universität München, Deutschland, sowie an der Universität Lund, Schweden. Er promovierte am Helmholtz-Zentrum München unter der Leitung von Reinhard Köster und entwickelte genetische Genexpressionswerkzeuge zur Untersuchung der Entwicklung des Kleinhirns im Zebrafisch. Zudem arbeitete er mit Daniel Razansky am Helmholtz-Zentrum München zusammen, um die opto-akustische Bildgebung für Zebrafische zu entwickeln. Als Postdoktorand war er im Labor von David Traver an der University of California, San Diego, im Bereich der Hämatopoese von Zebrafischen tätig.
Im Jahr 2014 kam Distel an die St. Anna Kinderkrebsforschung, wo er ein Zebrafischlabor und eine Zebrafischanlage aufbaute. Seit 2017 ist er auch Leiter der Zebrafisch-Plattform Österreich für präklinisches Wirkstoffscreening an der St. Anna Kinderkrebsforschung.
Über Sabine Taschner-Mandl
Dr. Sabine Taschner-Mandl leitet seit 2018 die Gruppe Tumor Biology der St. Anna Kinderkrebsforschung, wo sie seit 2008 wissenschaftlich tätig ist. Zusätzlich übt die Forscherin eine Lehrtätigkeit an der Medizinischen Universität Wien sowie der Technischen Universität Wien aus. Ihr Biologiestudium an der Universität Wien schloss Taschner-Mandl mit einer Diplomarbeit in der Impfstoffentwicklung der Firma Intercell ab. Es folgten eine Dissertation sowie eine Post-doc-Position am Institut für Immunologie der Medizinischen Universität Wien. Neben ihrer Tätigkeit an der St. Anna Kinderkrebsforschung war Taschner-Mandl im Rahmen des EC-FP7-Marie-Curie-Programms Gastwissenschaftlerin bei Significo und der University of Helsinki. Für ihre Forschung erhielt Taschner-Mandl zahlreiche Förderungen, unter anderem der Österreichischen Forschungsförderungsgesellschaft, dem Wiener Wissenschafts- Forschungs- und Technologie-Fonds und der ERA-NET-Initiative der Europäischen Kommission.
